Qu’est-ce que l’ionisation
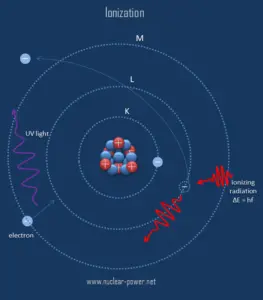 L’ionisation est le processus dans lequel un atome ou une molécule gagne ou perd des électrons pour former un ion chargé. L’ionisation peut résulter de la perte d’un électron après des collisions avec des particules subatomiques énergétiques, des collisions avec d’autres atomes, molécules et ions, ou par l’interaction avec un rayonnement électromagnétique. En général, le rayonnement ionisant est tout rayonnement (particules ou ondes électromagnétiques) qui transporte suffisamment d’énergie pour éliminer les électrons des atomes ou des molécules, les ionisant ainsi. Pour le rayonnement ionisant, l’énergie cinétique des particules ( photons, électrons, etc. ) est suffisante et la particule peut ioniser (pour former des ions en perdant des électrons) des atomes cibles pour former des ions.
L’ionisation est le processus dans lequel un atome ou une molécule gagne ou perd des électrons pour former un ion chargé. L’ionisation peut résulter de la perte d’un électron après des collisions avec des particules subatomiques énergétiques, des collisions avec d’autres atomes, molécules et ions, ou par l’interaction avec un rayonnement électromagnétique. En général, le rayonnement ionisant est tout rayonnement (particules ou ondes électromagnétiques) qui transporte suffisamment d’énergie pour éliminer les électrons des atomes ou des molécules, les ionisant ainsi. Pour le rayonnement ionisant, l’énergie cinétique des particules ( photons, électrons, etc. ) est suffisante et la particule peut ioniser (pour former des ions en perdant des électrons) des atomes cibles pour former des ions.
La frontière entre les rayonnements ionisants et non ionisants n’est pas clairement définie, car différentes molécules et atomes s’ionisent à différentes énergies. Les rayons gamma , les rayons X , et la partie ultraviolette du spectre plus élevée sont ionisants, alors que l’ultraviolet inférieur, la lumière visible (y compris la lumière laser), infrarouge, micro – ondes et les ondes radio sont considérés comme des rayonnements non ionisants.
Énergie d’ionisation
L’énergie d’ionisation , également appelée potentiel d’ionisation , est l’énergie nécessaire pour retirer un électron de l’atome neutre.
Énergie X + → X + + e –
où X est n’importe quel atome ou molécule capable d’être ionisé, X + est cet atome ou molécule avec un électron retiré (ion positif), et e – est l’électron retiré.
Un atome d’azote, par exemple, nécessite l’énergie d’ionisation suivante pour éliminer l’électron le plus à l’extérieur.
N + IE → N + + e – IE = 14,5 eV
L’énergie d’ionisation associée à l’élimination du premier électron est la plus couramment utilisée. La n e énergie d’ionisation fait référence à la quantité d’énergie requise pour retirer un électron de l’espèce avec une charge de ( n -1).
1ère énergie d’ionisation
X → X + + e –
2ème énergie d’ionisation
X + → X 2+ + e –
3e énergie d’ionisation
X 2+ → X 3+ + e –
Énergie d’ionisation pour différents éléments
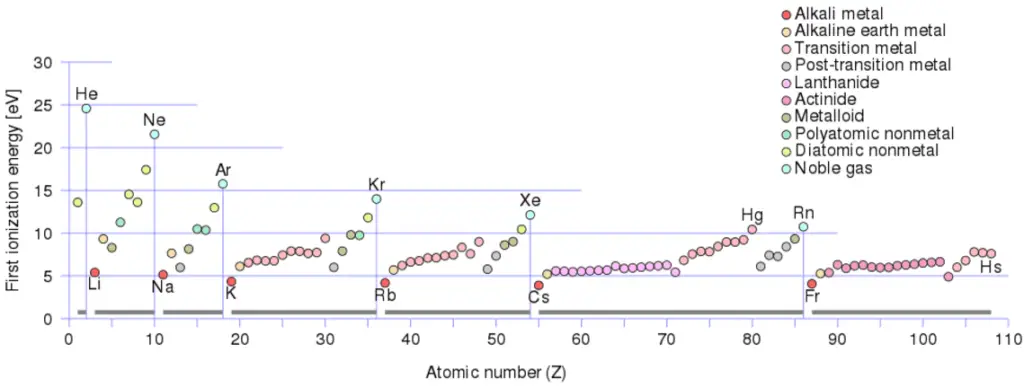
Il existe une énergie d’ionisation pour chaque électron successif retiré. Les électrons qui entourent le noyau se déplacent sur des orbites assez bien définies. Certains de ces électrons sont plus étroitement liés dans l’atome que d’autres. Par exemple, seulement 7,38 eV sont nécessaires pour retirer l’électron le plus à l’extérieur d’un atome de plomb, tandis que 88 000 eV sont requis pour éliminer l’électron le plus à l’intérieur. Aide à comprendre la réactivité des éléments (en particulier les métaux, qui perdent des électrons).
En général, l’énergie d’ionisation augmente en remontant un groupe et en se déplaçant de gauche à droite sur une période. De plus:
- L’énergie d’ionisation est la plus faible pour les métaux alcalins qui ont un seul électron à l’extérieur d’une coquille fermée.
- L’énergie d’ionisation augmente à travers une rangée sur le maximum périodique pour les gaz nobles qui ont des coquilles fermées
Par exemple, le sodium ne nécessite que 496 kJ / mol ou 5,14 eV / atome pour l’ioniser. Par contre le néon, le gaz noble, qui le précède immédiatement dans le tableau périodique, nécessite 2081 kJ / mol ou 21,56 eV / atome.
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: [email protected] ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci