O que é ionização
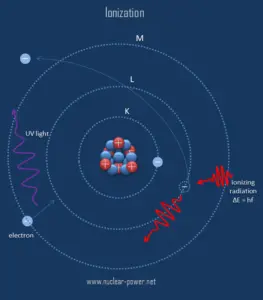 A ionização é o processo no qual um átomo ou molécula ganha ou perde elétrons para formar íons carregados. A ionização pode resultar da perda de um elétron após colisões com partículas subatômicas energéticas, colisões com outros átomos, moléculas e íons ou através da interação com radiação eletromagnética. Em geral, radiação ionizante é qualquer radiação (partículas ou ondas eletromagnéticas) que transporta energia suficiente para derrubar elétrons de átomos ou moléculas, ionizando-os. Para radiação ionizante, a energia cinética das partículas ( fótons, elétrons, etc. ) é suficiente e a partícula pode ionizar (formar íons pela perda de elétrons) atingir átomos para formar íons.
A ionização é o processo no qual um átomo ou molécula ganha ou perde elétrons para formar íons carregados. A ionização pode resultar da perda de um elétron após colisões com partículas subatômicas energéticas, colisões com outros átomos, moléculas e íons ou através da interação com radiação eletromagnética. Em geral, radiação ionizante é qualquer radiação (partículas ou ondas eletromagnéticas) que transporta energia suficiente para derrubar elétrons de átomos ou moléculas, ionizando-os. Para radiação ionizante, a energia cinética das partículas ( fótons, elétrons, etc. ) é suficiente e a partícula pode ionizar (formar íons pela perda de elétrons) atingir átomos para formar íons.
O limite entre a radiação ionizante e a não ionizante não é claramente definido, uma vez que diferentes moléculas e átomos ionizam em energias diferentes. Raios gama , raios X e a parte ultravioleta mais alta do espectro são ionizantes, enquanto os raios ultravioleta mais baixos, luz visível (incluindo luz laser), infravermelho, microondas e ondas de rádio são considerados radiação não ionizante.
Energia de ionização
Energia de ionização , também chamada potencial de ionização , é a energia necessária para remover um elétron do átomo neutro.
X + energia → X + + e –
onde X é qualquer átomo ou molécula capaz de ser ionizada, X + é aquele átomo ou molécula com um elétron removido (íon positivo) e e – é o elétron removido.
Um átomo de nitrogênio, por exemplo, requer a seguinte energia de ionização para remover o elétron mais externo.
N + IE → N + + e – IE = 14,5 eV
A energia de ionização associada à remoção do primeiro elétron é mais comumente usada. O n de energia de ionização th refere-se à quantidade de energia necessária para remover um electrão a partir das espécies com uma taxa de ( n -1).
1a energia de ionização
X → X + + e –
2a energia de ionização
X + → X 2+ + e –
3a energia de ionização
X 2+ → X 3+ + e –
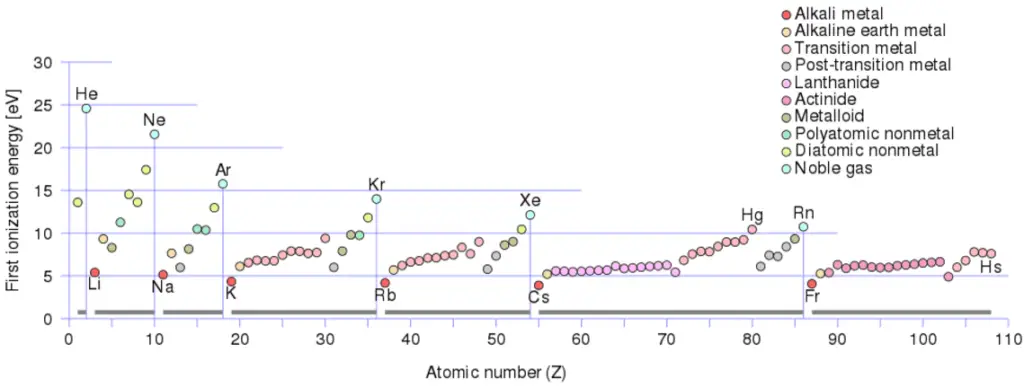
Energia de ionização para diferentes elementos
Existe uma energia de ionização para cada elétron sucessivo removido. Os elétrons que circundam o núcleo se movem em órbitas bastante bem definidas. Alguns desses elétrons estão mais fortemente ligados ao átomo do que outros. Por exemplo, apenas 7,38 eV são necessários para remover o elétron mais externo de um átomo de chumbo, enquanto 88.000 eV são necessários para remover o elétron mais interno. Ajuda a entender a reatividade de elementos (especialmente metais, que perdem elétrons).
Em geral, a energia de ionização aumenta subindo um grupo e movendo da esquerda para a direita ao longo de um período. Além disso:
- A energia de ionização é mais baixa para os metais alcalinos que possuem um único elétron fora de uma concha fechada.
- A energia de ionização aumenta em uma linha no máximo periódico para os gases nobres que fecharam as conchas
Por exemplo, o sódio requer apenas 496 kJ / mol ou 5,14 eV / átomo para ionizá-lo. Por outro lado, o neon, o gás nobre, imediatamente anterior à tabela periódica, requer 2081 kJ / mol ou 21,56 eV / átomo.
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: [email protected] ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.