Was ist Ionisation?
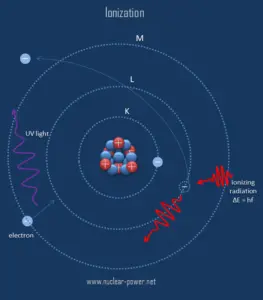 Ionisation ist der Prozess, bei dem ein Atom oder ein Molekül Elektronen gewinnt oder verliert , um geladene Ionen zu bilden. Die Ionisierung kann durch den Verlust eines Elektrons nach Kollisionen mit energetischen subatomaren Partikeln, Kollisionen mit anderen Atomen, Molekülen und Ionen oder durch die Wechselwirkung mit elektromagnetischer Strahlung entstehen. Im Allgemeinen ist ionisierende Strahlung jede Strahlung (Teilchen oder elektromagnetische Wellen), die genug Energie trägt, um Elektronen von Atomen oder Molekülen zu stoßen und sie dadurch zu ionisieren. Für ionisierende Strahlung ist die kinetische Energie von Partikeln ( Photonen, Elektronen usw. ) ausreichend und das Partikel kann Zielatome ionisieren (um Ionen durch Elektronenverlust zu bilden), um Ionen zu bilden.
Ionisation ist der Prozess, bei dem ein Atom oder ein Molekül Elektronen gewinnt oder verliert , um geladene Ionen zu bilden. Die Ionisierung kann durch den Verlust eines Elektrons nach Kollisionen mit energetischen subatomaren Partikeln, Kollisionen mit anderen Atomen, Molekülen und Ionen oder durch die Wechselwirkung mit elektromagnetischer Strahlung entstehen. Im Allgemeinen ist ionisierende Strahlung jede Strahlung (Teilchen oder elektromagnetische Wellen), die genug Energie trägt, um Elektronen von Atomen oder Molekülen zu stoßen und sie dadurch zu ionisieren. Für ionisierende Strahlung ist die kinetische Energie von Partikeln ( Photonen, Elektronen usw. ) ausreichend und das Partikel kann Zielatome ionisieren (um Ionen durch Elektronenverlust zu bilden), um Ionen zu bilden.
Die Grenze zwischen ionisierender und nichtionisierender Strahlung ist nicht scharf definiert, da unterschiedliche Moleküle und Atome bei unterschiedlichen Energien ionisieren. Gammastrahlen , Röntgenstrahlen und der höhere ultraviolette Teil des Spektrums ionisieren, während das niedrigere ultraviolette, sichtbare Licht (einschließlich Laserlicht), Infrarot, Mikrowellen und Radiowellen als nichtionisierende Strahlung betrachtet werden.
Ionisationsenergie
Ionisierungsenergie , auch Ionisierungspotential genannt , ist die Energie, die erforderlich ist, um ein Elektron aus dem neutralen Atom zu entfernen .
X + Energie → X + + e –
wobei X ein Atom oder Molekül ist, das ionisiert werden kann, ist X + das Atom oder Molekül, bei dem ein Elektron entfernt ist (positives Ion), und e – ist das entfernte Elektron.
Ein Stickstoffatom benötigt beispielsweise die folgende Ionisierungsenergie, um das äußerste Elektron zu entfernen.
N + IE → N + + e – IE = 14,5 eV
Die mit der Entfernung des ersten Elektrons verbundene Ionisierungsenergie wird am häufigsten verwendet. Die n- te Ionisierungsenergie bezieht sich auf die Energiemenge, die erforderlich ist, um ein Elektron mit einer Ladung von ( n –1) aus der Spezies zu entfernen .
1. Ionisierungsenergie
X → X + + e –
2. Ionisierungsenergie
X + → X 2+ + e –
3. Ionisierungsenergie
X 2+ → X 3+ + e –
Ionisierungsenergie für verschiedene Elemente
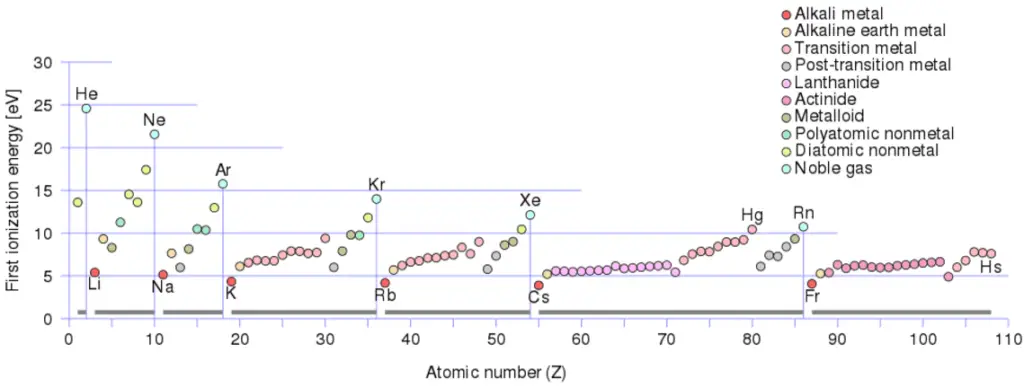
Für jedes aufeinanderfolgende entfernte Elektron gibt es eine Ionisierungsenergie. Die Elektronen, die den Kern umkreisen, bewegen sich in ziemlich genau definierten Bahnen. Einige dieser Elektronen sind im Atom fester gebunden als andere. Zum Beispiel sind nur 7,38 eV erforderlich, um das äußerste Elektron von einem Bleiatom zu entfernen, während 88.000 eV erforderlich sind, um das innerste Elektron zu entfernen. Hilft, die Reaktivität von Elementen (insbesondere Metallen, die Elektronen verlieren) zu verstehen.
Im Allgemeinen nimmt die Ionisierungsenergie zu, wenn eine Gruppe nach oben und über einen Zeitraum von links nach rechts bewegt wird. Außerdem:
- Die Ionisierungsenergie ist für die Alkalimetalle am niedrigsten, die ein einzelnes Elektron außerhalb einer geschlossenen Hülle haben.
- Die Ionisierungsenergie steigt über eine Reihe auf das periodische Maximum für die Edelgase, die geschlossene Schalen haben
Zum Beispiel benötigt Natrium nur 496 kJ / mol oder 5,14 eV / Atom, um es zu ionisieren. Andererseits benötigt Neon, das im Periodensystem unmittelbar davor stehende Edelgas, 2081 kJ / mol oder 21,56 eV / Atom.
……………………………………………………………………………………………………………………………….
Dieser Artikel basiert auf der maschinellen Übersetzung des englischen Originalartikels. Weitere Informationen finden Sie im Artikel auf Englisch. Sie können uns helfen. Wenn Sie die Übersetzung korrigieren möchten, senden Sie diese bitte an: [email protected] oder füllen Sie das Online-Übersetzungsformular aus. Wir bedanken uns für Ihre Hilfe und werden die Übersetzung so schnell wie möglich aktualisieren. Danke.